|
|
Luktsinnet och molekylerDra försiktigt in luft genom näsan. Vilka lukter känner du? Kanske är det någon som luktar svett eller har släppt en fis. Kan det vara någon som har en parfym som luktar blommigt? Är det en svag lukt av mat från köket? Kanske luktar det klippt gräs eller bilavgaser. Tänk efter ett slag. Hur uppfattar du lukterna? Vissa lukter är otrevliga. Du kanske till och med får kväljningar. Andra lukter är behagliga. Kanske är det lukten av någon du tycker om. Oavsett vilket, så är det molekyler du reagerar på. Lukter är molekyler som binder till luktreceptorer
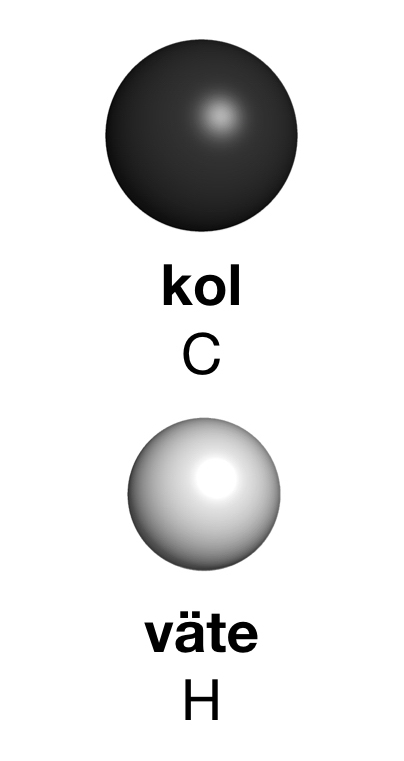
När vi drar in luft genom näsan följer molekyler av olika slag med, andra molekyler än luftens egna. Några centimeter bakom näsan finns ett område av celler som kallas luktepitel. Det är ungefär lika stort som ett frimärke. Luktepitelet består av luktceller. Det är specialiserade nervceller som är direkt kopplade till hjärnan. Varje luktcell har så kallade luktreceptorer. En receptor är en biologisk molekyl som kan skicka en signal från utsidan av en cell till insidan. En luktreceptor skickar sedan signaler vidare som hjärnan uppfattar som lukter. Signalen uppkommer då en viss molekyl skapar svaga bindningar till en luktreceptor. Lukter är alltså information om molekyler som vi kan känna med hjälp av luktreceptorer och luktceller. Luktsinnet och smaksinnet brukar kallas för de kemiska sinnena. Olika molekyler ger upphov till olika lukter. Det är molekylernas form och vilka atomer de består av som avgör vad de luktar och smakar. Molekyler som liknar varandra har ofta liknande lukt, till exempel fruktigt eller blommigt. Det finns flera sätt att visa molekylerFör att förstå hur molekyler fungerar måste vi kunna visa hur de ser ut. Ett sätt är att använda olika typer av modeller, exempelvis plastmodeller där atomslagen visas som kulor i olika färger. I modellen är kolatomer svarta eller mörkgrå, och väteatomer är vita. Ofta använder vi så kallade kalottmodeller. I en kalottmodell visas hur stor en atom är i proportion till andra atomer. Olika atomer är olika stora. I skolan används ofta fysiska molekylmodeller medan kemister för det mesta gör digitala tredimensionella bilder av molekylerna i en dator. Ibland passar det bättre att rita upp molekylens kemiska struktur. I sådana bilder har varje atomslag en egen beteckning. Kol har beteckningen C. Väte har beteckningen H. Beteckningarna är internationella så med hjälp av detta kemiska språk går det att prata kemi med människor över hela jorden.
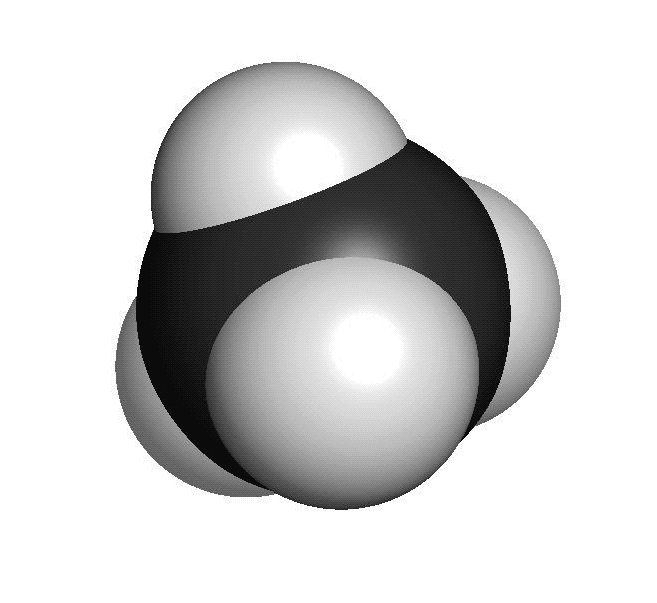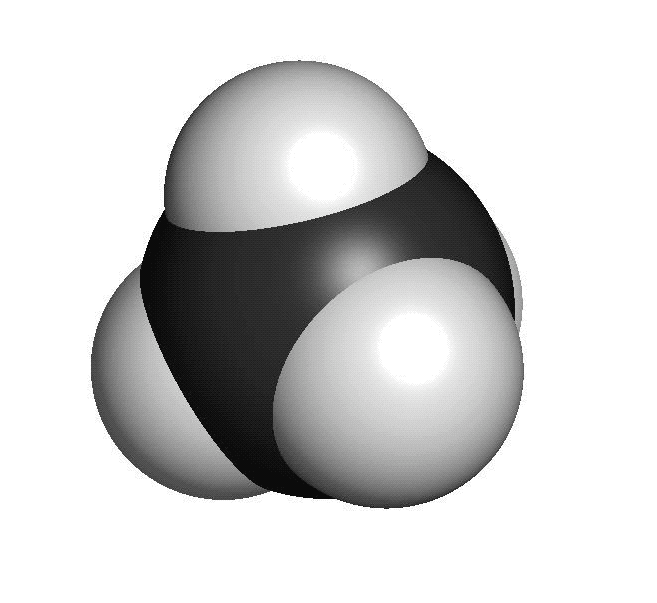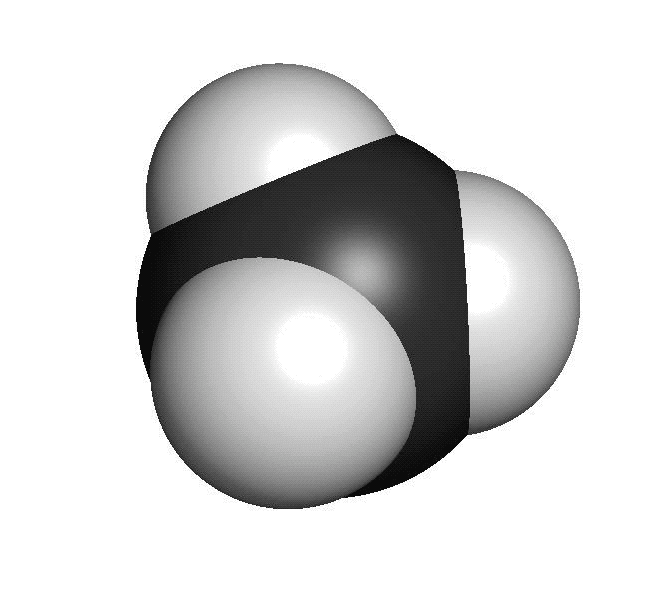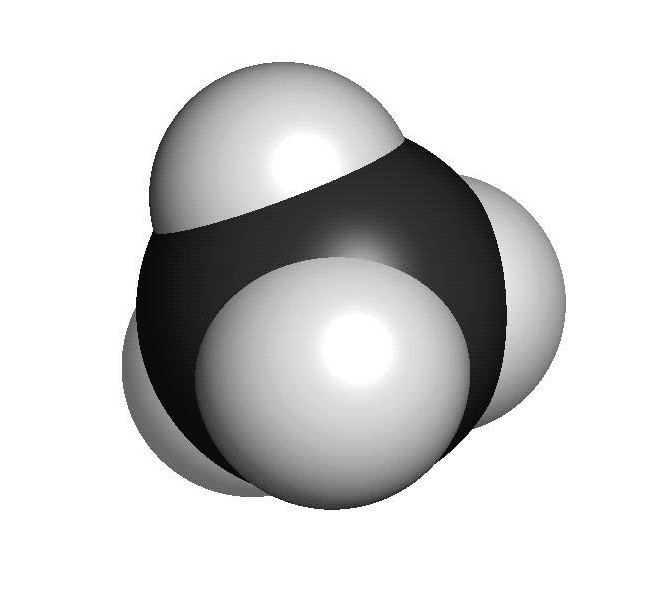
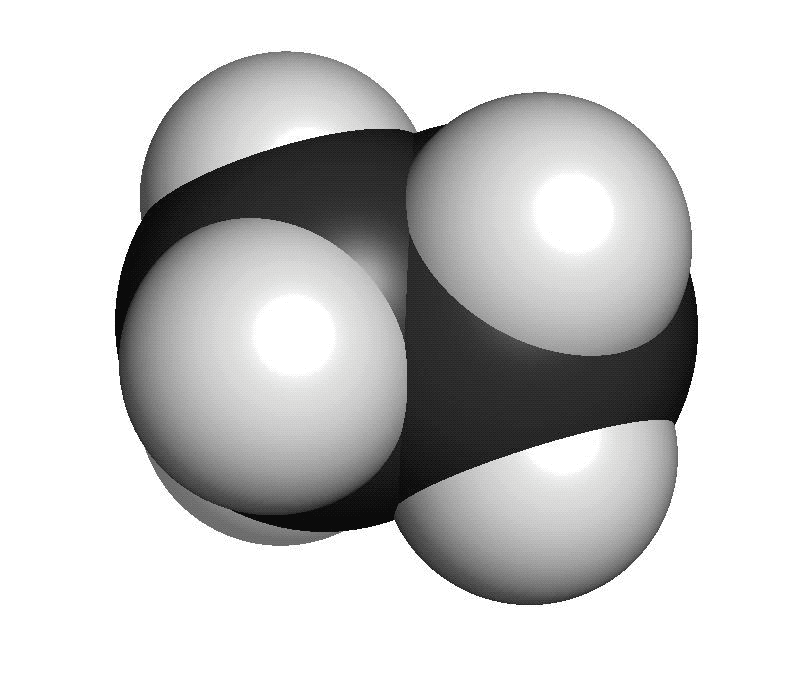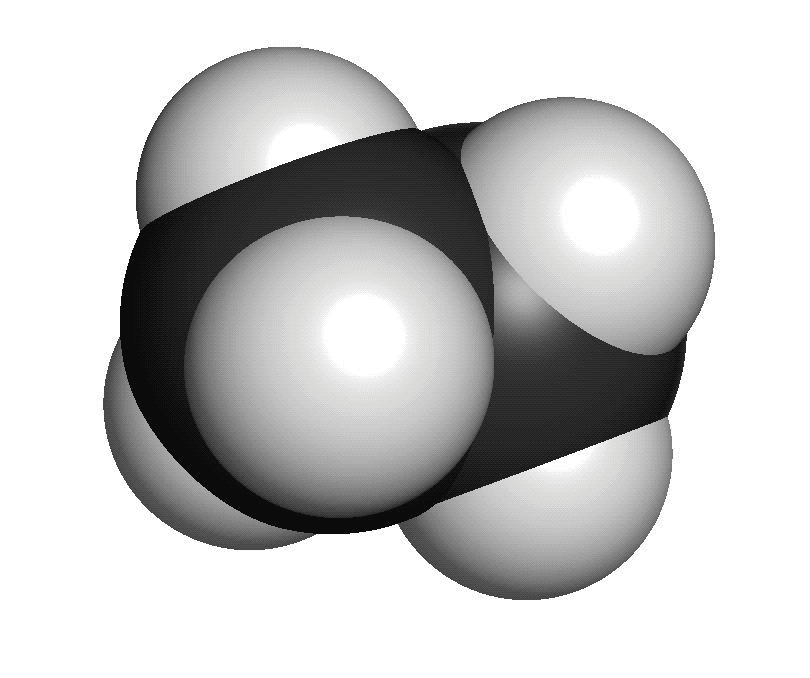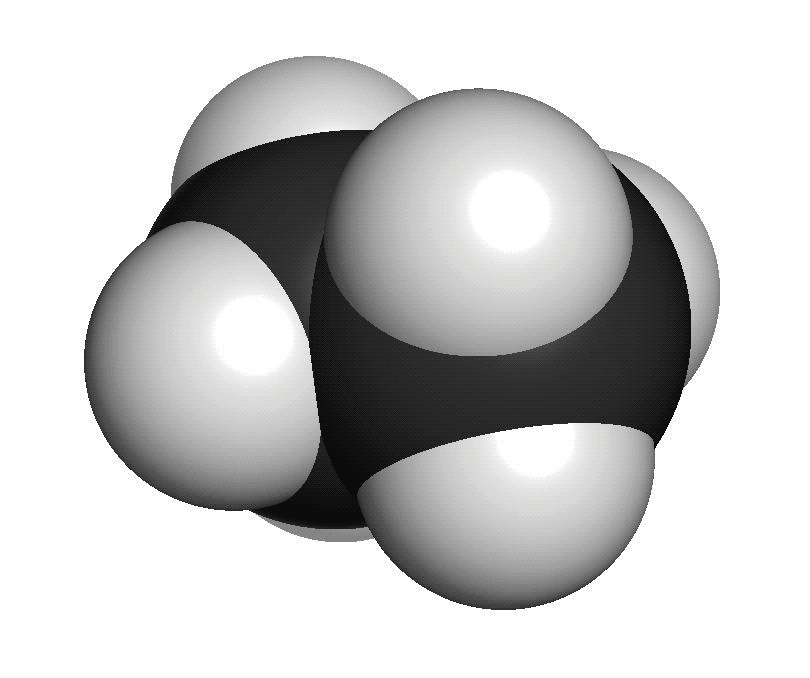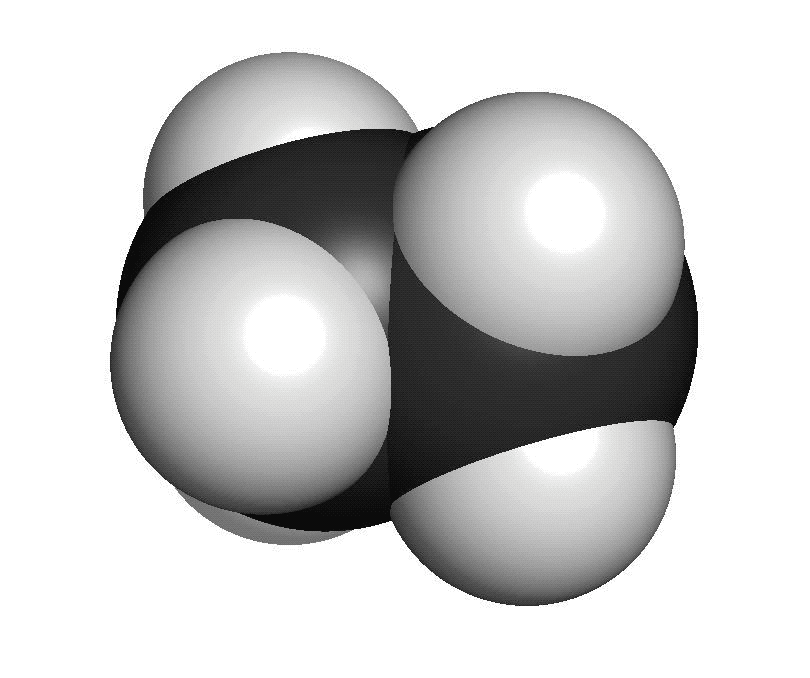
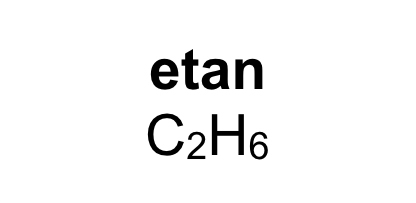
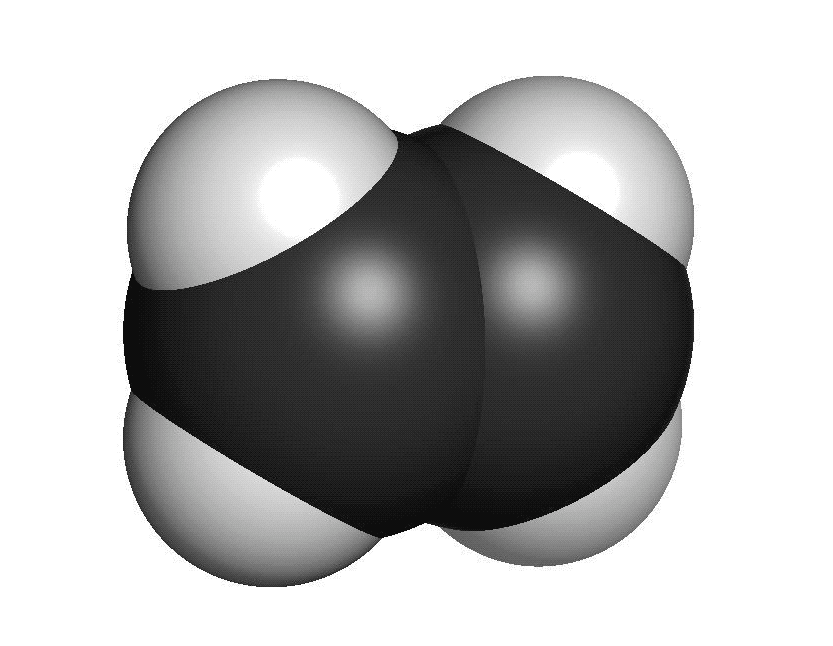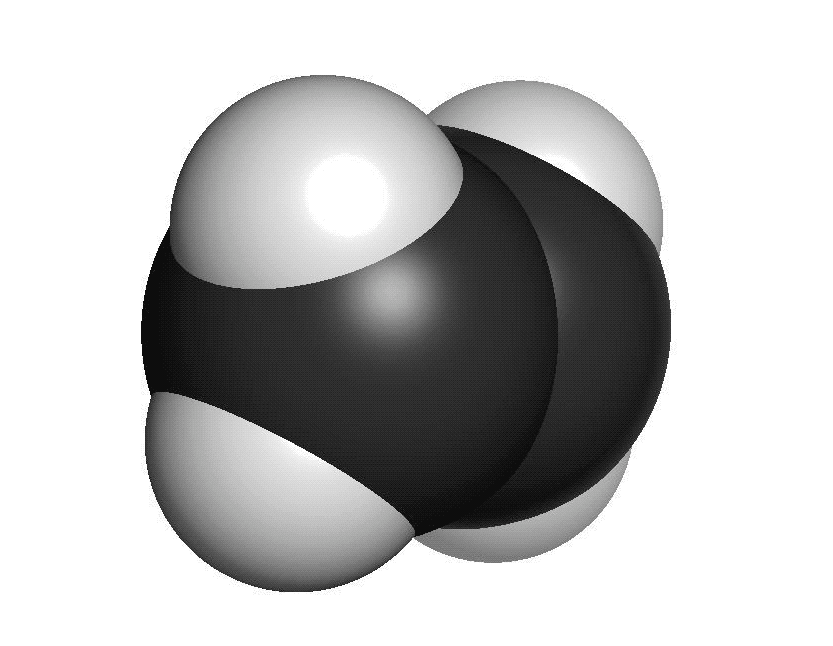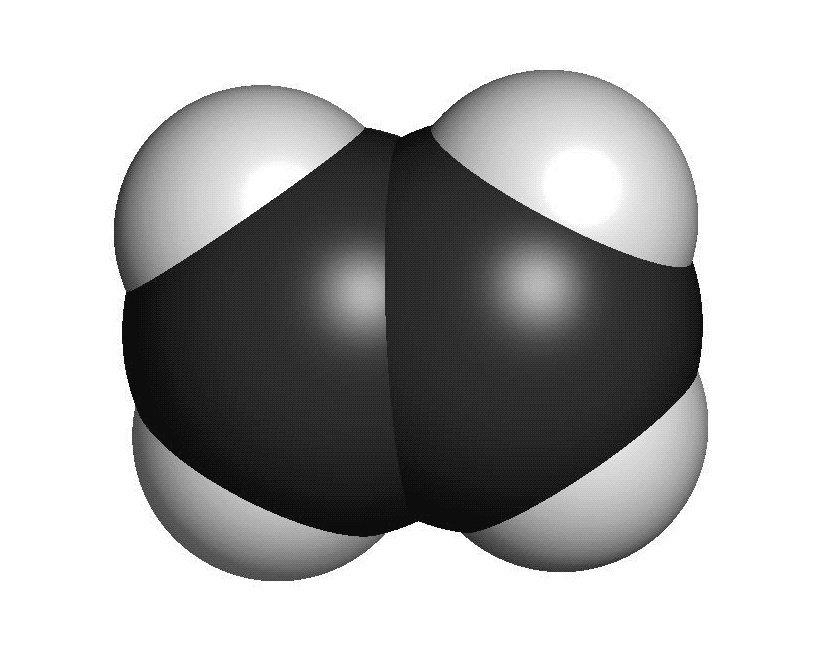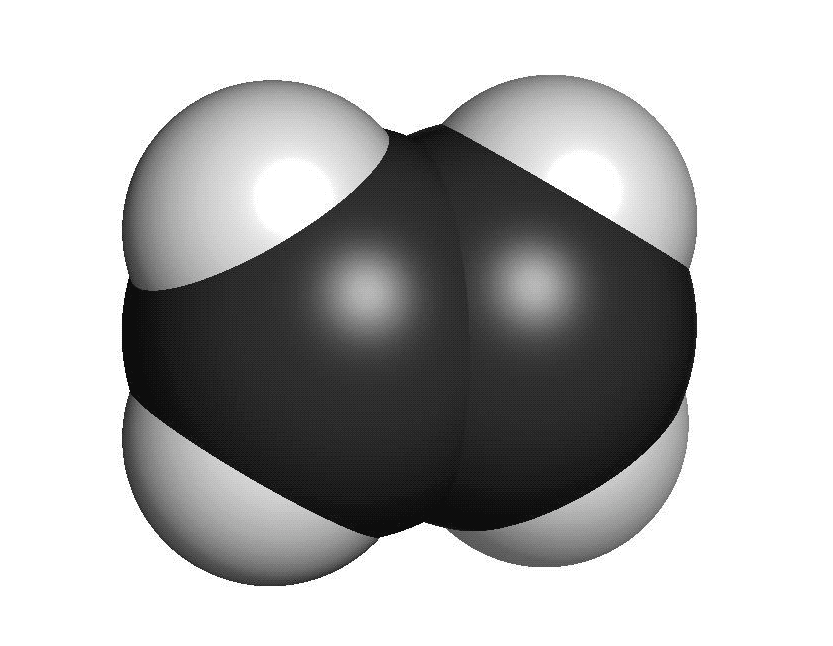
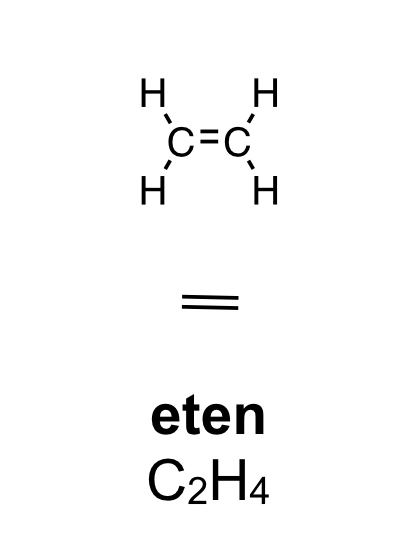
Organiska ämnen är uppbyggda av kol och väteFör att vi ska förstå hur molekylerna luktar måste vi först studera hur de ser ut. En molekyl kan vara uppbyggd av i stort sett vilka atomslag som helst. När det gäller våra sinnen är det oftast bara frågan om ett fåtal atomslag. De flesta luktande ämnen är exempel på så kallade organiska molekyler. Organiska molekyler är uppbyggda med atomslagen kol och väte som grund. Varje kolatom kan bilda fyra kovalenta bindningar till andra atomer. En bindning mellan atomer brukar ritas som ett streck. Detta sätt att rita molekyler kallas därför för streckformler. Ofta binder flera kolatomer till varandra och bildar en kedja. De positioner som inte är upptagna av bindningar till andra kolatomer binder ofta till väteatomer. Varje väteatom kan bara bilda en bindning till andra atomer. Den enklaste organiska molekylen heter metan. Den består av en kolatom som binder till fyra väteatomer. Ifall vi lägger till en kolatom och två väteatomer får vi etan. Etan består alltså av två kolatomer som sitter ihop. Varje kolatom binder då tre väteatomer. Kom ihåg att varje kolatom bara kan ha fyra bindningar totalt. Organiska molekyler som innehåller väldigt många atomer är svåra att rita med streckformler. Då används istället en skelettformel. I en skelettformel ritar vi bara ut strecken mellan kolatomerna. Vi ritar inte ut väteatomerna som binder till kolatomerna. Vi skriver heller inte ut beteckningen C för kolatomerna. Eftersom varje kolatom måste ha fyra bindningar kan vi därför räkna ut hur många väteatomer som sitter på varje kolatom.
En molekyl som består av fyra kolatomer och tio väteatomer kan byggas ihop på två olika sätt. En möjlighet är att vi bygger en rak kedja med fyra atomer i. En annan möjlighet är att vi låter en kolatom binda till tre andra kolatomer. Vi kallar det för att kedjan har en förgrening. Dessa båda ämnen har samma kemiska sammansättning. Båda ämnena består alltså av fyra kolatomer och tio väteatomer. De har dock olika uppbyggnad. Det kallas för isomeri. De båda molekylerna är isomerer till varandra. Eftersom molekyler kan vara nästan hur stora som helst finns det i teorin ett oändligt antal olika kemiska ämnen.
Organiska molekyler innehåller ofta andra atomslag än kol och väte
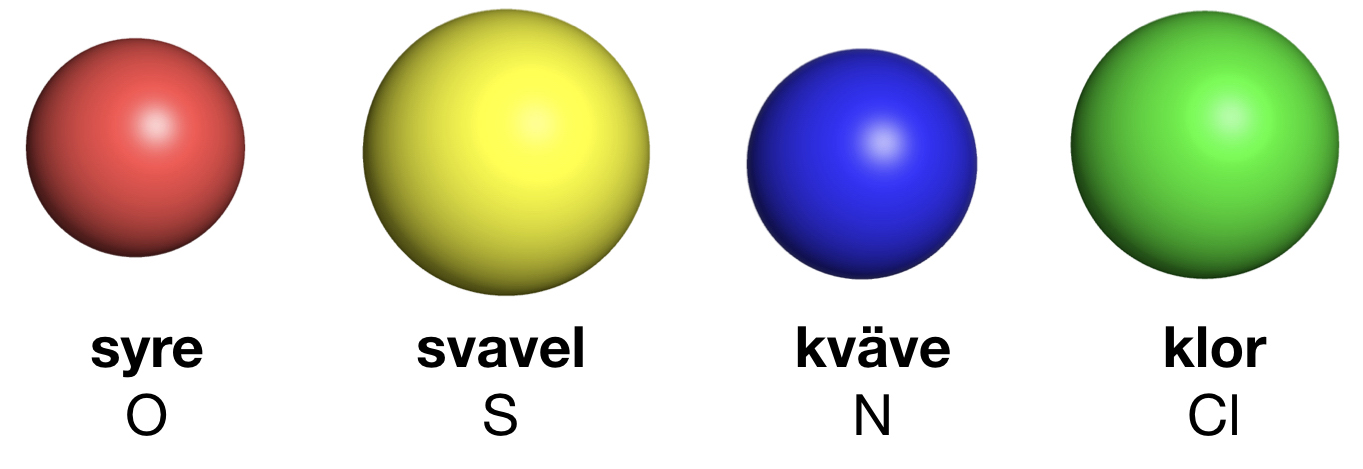
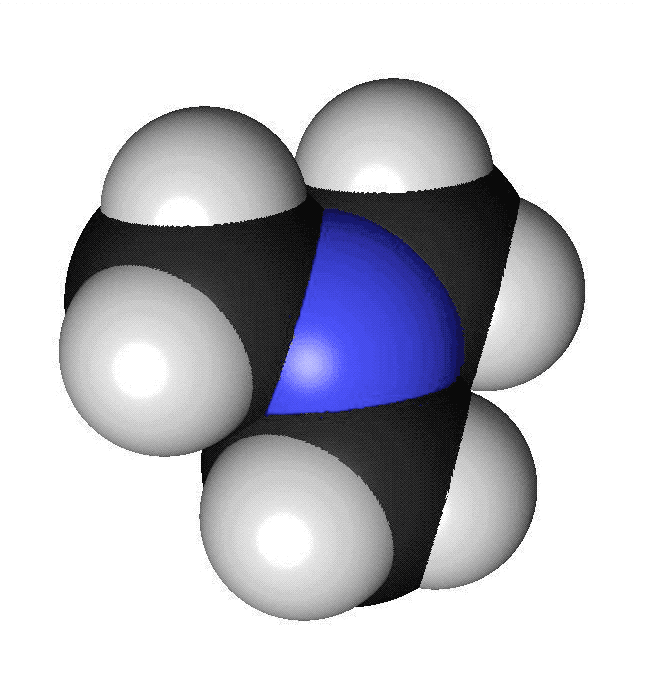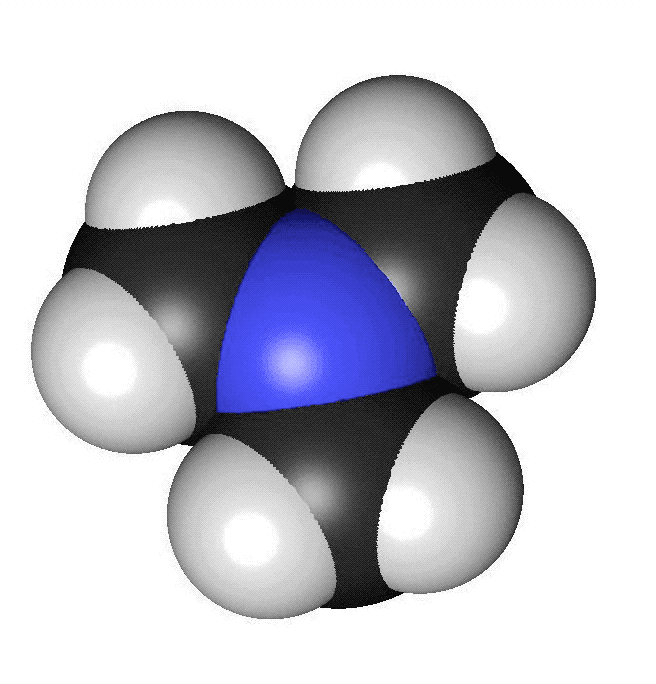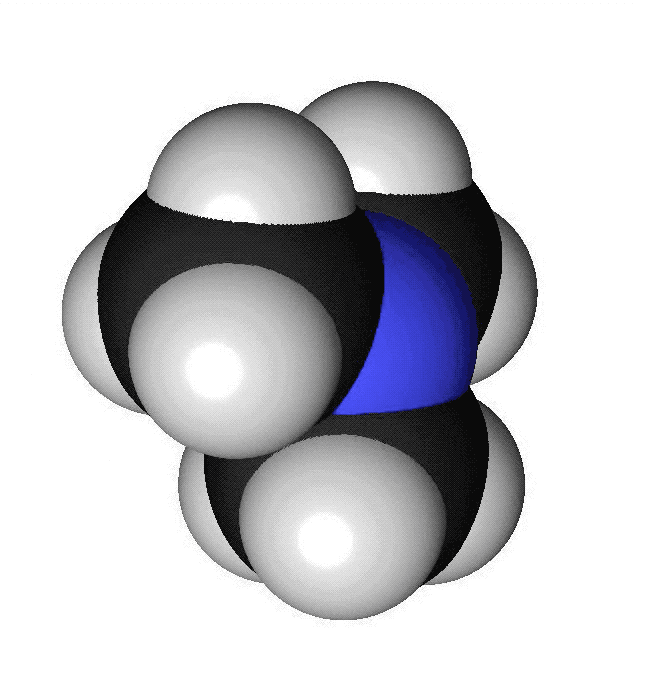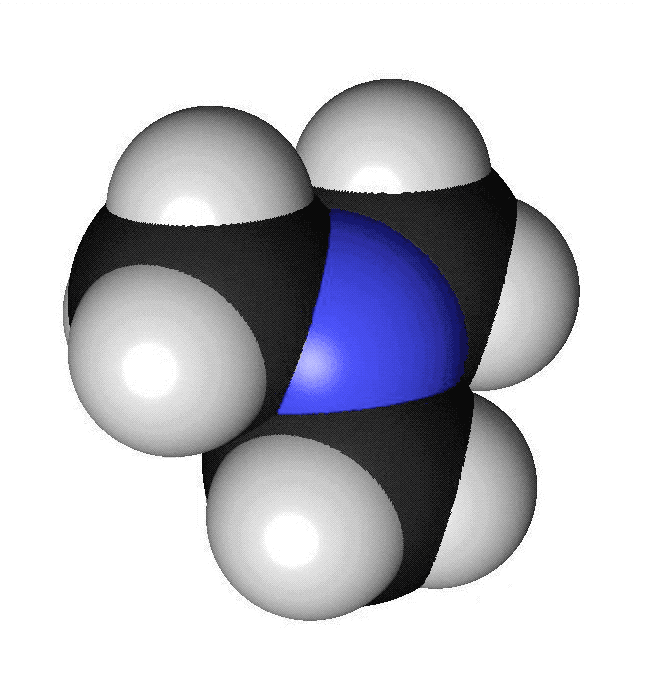
Förutom kol och väte ingår ofta andra atomslag i organiska molekyler. De vanligaste är syre, svavel, kväve och klor. Syreatomer är röda i modeller och har beteckningen O. Varje syreatom kan ha två bindningar till andra atomer. Svavelatomer visas med gul färg och har beteckningen S. Svavelatomer har ofta två bindningar till andra atomer. De kan dock ha fler. Kväveatomer markeras med blå färg och förkortas N. Kväve kan bilda tre bindningar till andra atomer. Kloratomer har oftast grön färg och förkortas Cl. Varje kloratom kan bilda en bindning till andra atomer. I vissa ämnen finns det dubbelbindningar. Då skapas två bindningar mellan två atomer. Det kan vara mellan två kolatomer eller mellan en kolatom och en syreatom. När vi ritar sådana ämnen så drar vi två streck mellan atomerna. Om en kolatom bildar en dubbelbindning finns det bara två bindningar över för att binda till andra atomer. Kom ihåg att varje kolatom bara får ha fyra bindningar. Att ett ämne luktar beror på vilken form det har. Isomerer luktar ofta helt olika. Lukten beror också på vilka atomslag som ingår och olika typer av kemiska ämnen har ofta olika lukt.
Organiska ämnen är indelade i olika grupperBeroende på hur de olika atomerna sitter ihop får vi kemiska ämnen med olika egenskaper. För att förenkla brukar vi samla ihop ämnen med liknande uppbyggnad i så kallade grupper. Inom varje grupp brukar egenskaperna hos ämnena vara ganska lika. Några vanliga grupper är alkoholer, karboxylsyror, estrar och aminer. Alkoholer liknar vatten och har ofta svag lukt
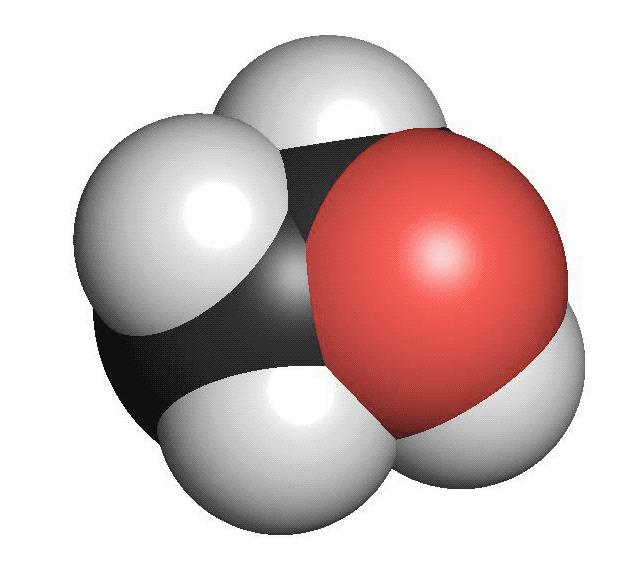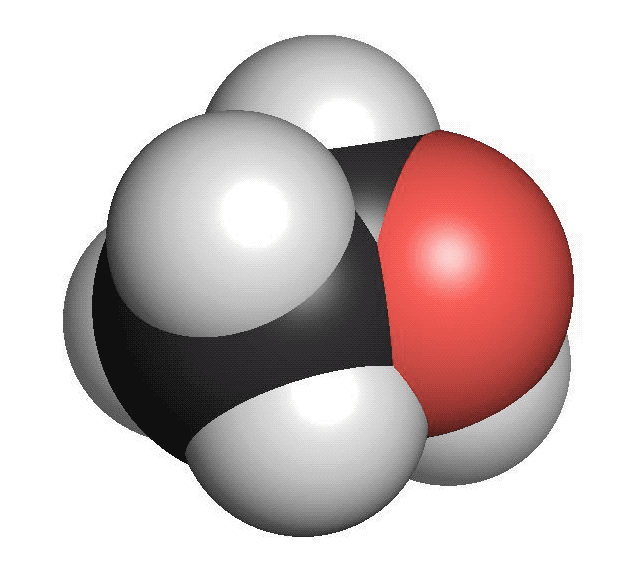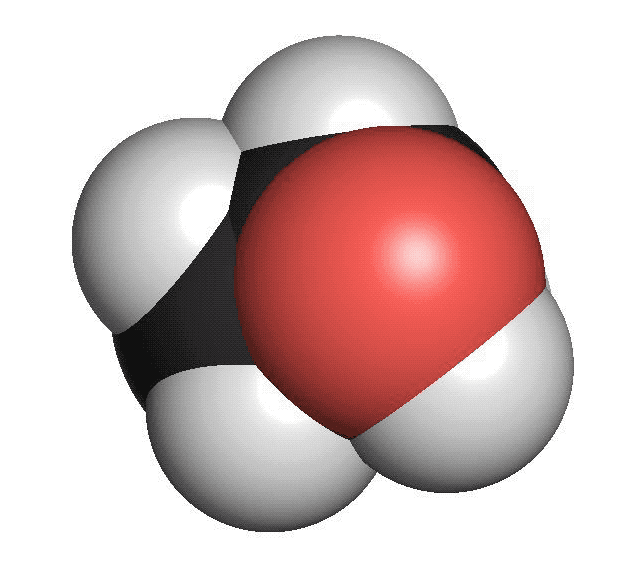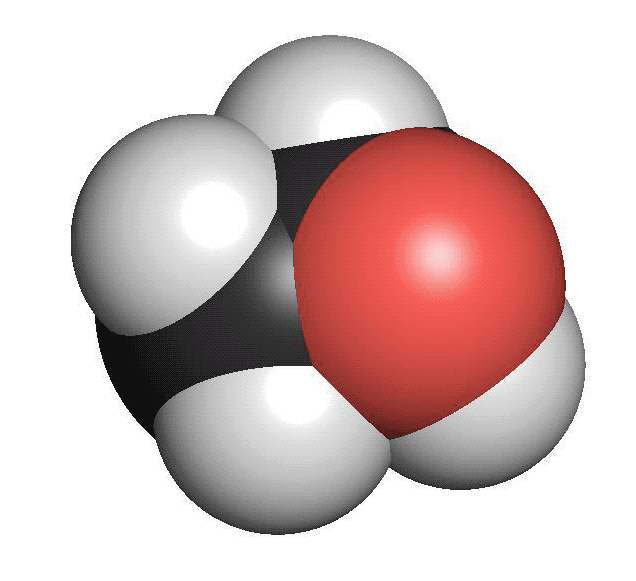
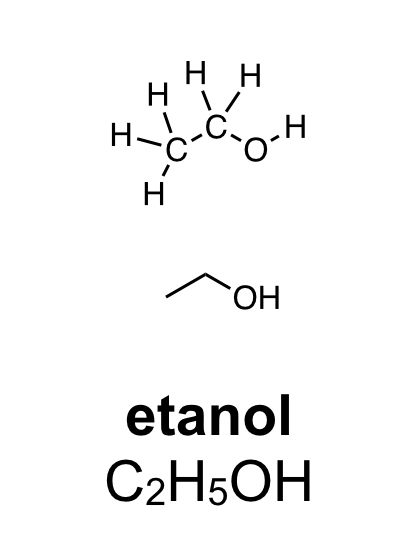
Alkoholer innehåller en hydroxylgrupp. Den består av en syreatom som binder till en väteatom (OH). Hydroxylgruppen binder i sin tur till en kolatom. Den enklaste alkoholen är metanol. Den består av en kolatom och en hydroxylgrupp. Etanol, som finns i öl, vin och sprit är en alkohol med två kolatomer och en hydroxylgrupp. Rödsprit, som bland annat används som bränsle, består av etanol. Den röda färgen är tillsatt för att varna för att den inte kan drickas. Alkoholer har sällan särskilt stark lukt.
Karboxylsyror luktar ofta skarpt eller illa
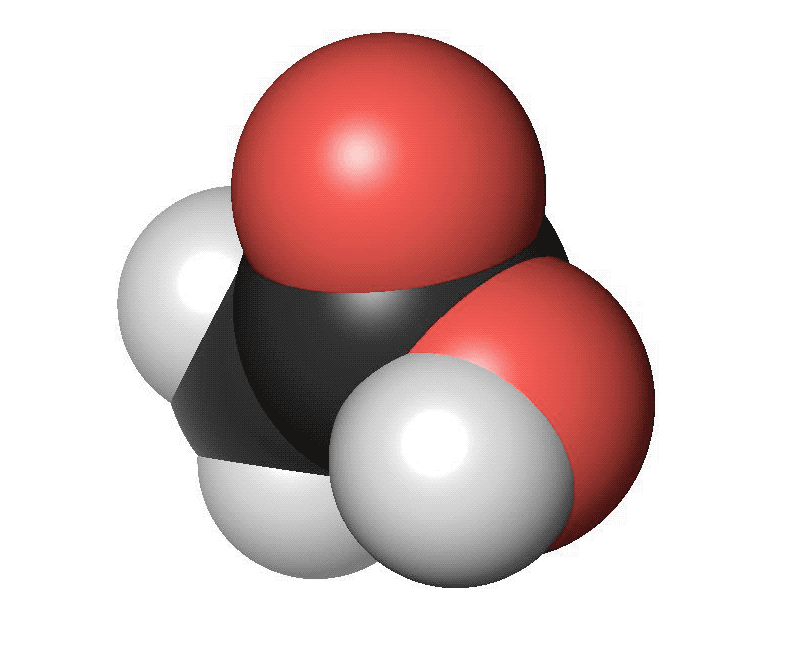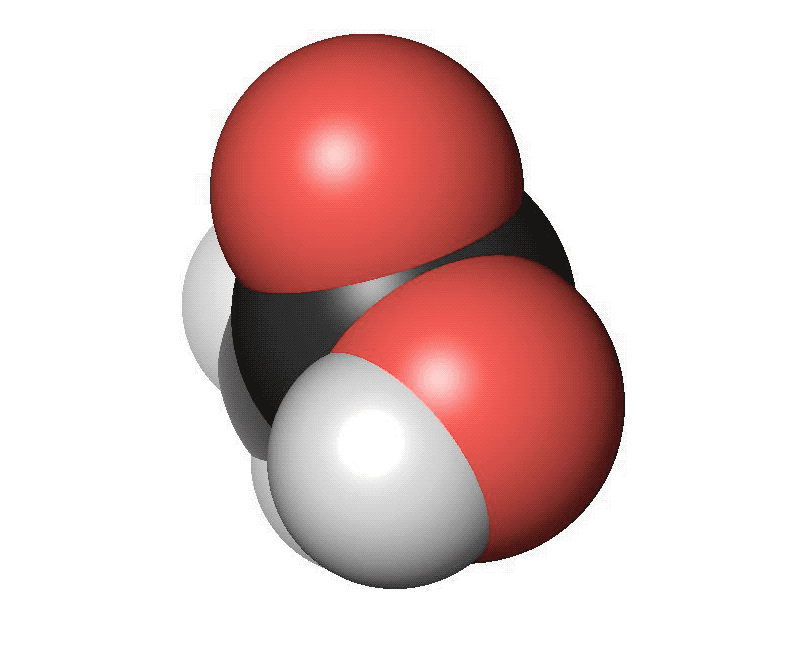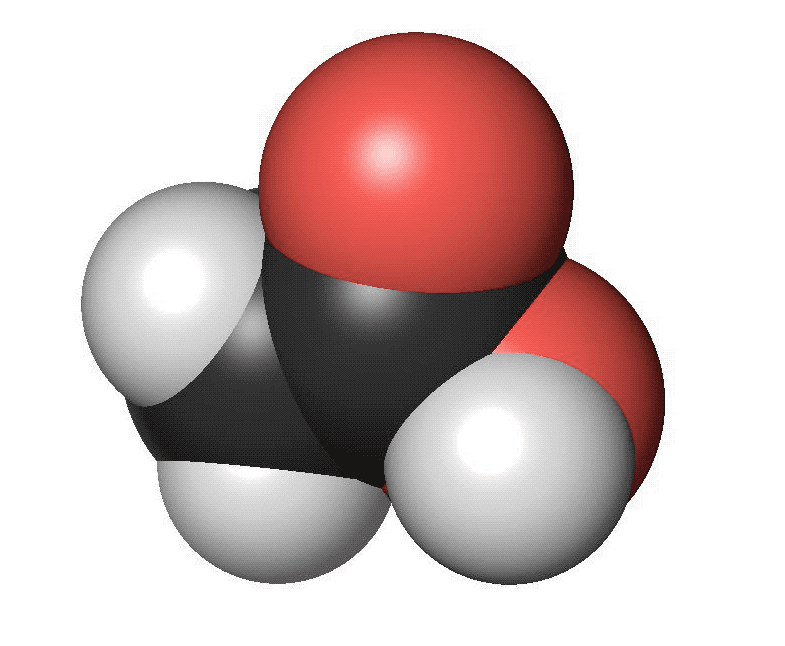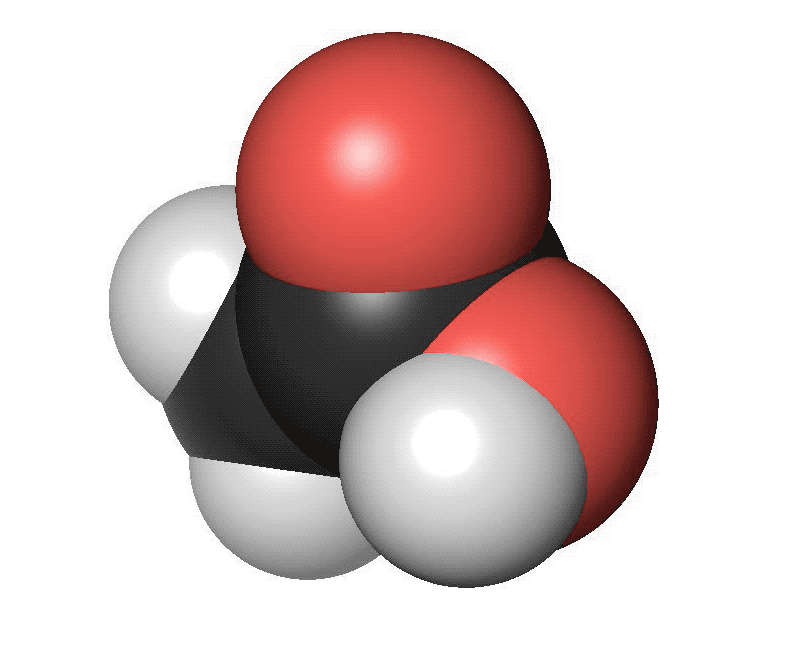
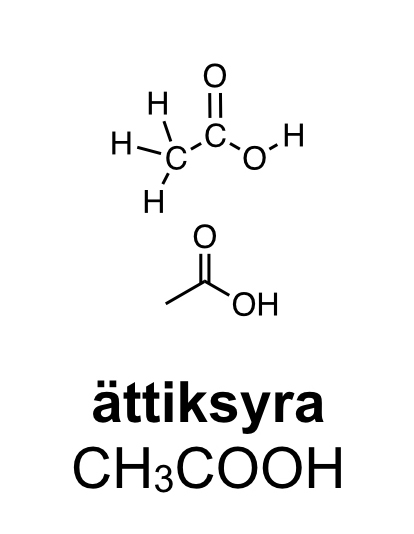
Karboxylsyror innehåller en karboxylsyragrupp. Det är en kolatom som har en dubbelbindning till en syreatom och samtidigt binder till en hydroxylgrupp (COOH). Den vanligaste karboxylsyran är ättiksyra. Ättiksyra har en kolatom bunden till en karboxylsyragrupp. Den finns i ättika och vinäger. Den har en skarp lukt. Den enklaste karboxylsyran är myrsyra som bara har en väteatom bunden till karboxylsyragruppen. Myror använder myrsyra för att skrämma bort inkräktare. Karboxylsyror med fyra eller fler kolatomer brukar ha obehagliga lukter. Ofta luktar de fotsvett.
Estrar luktar ofta frukt
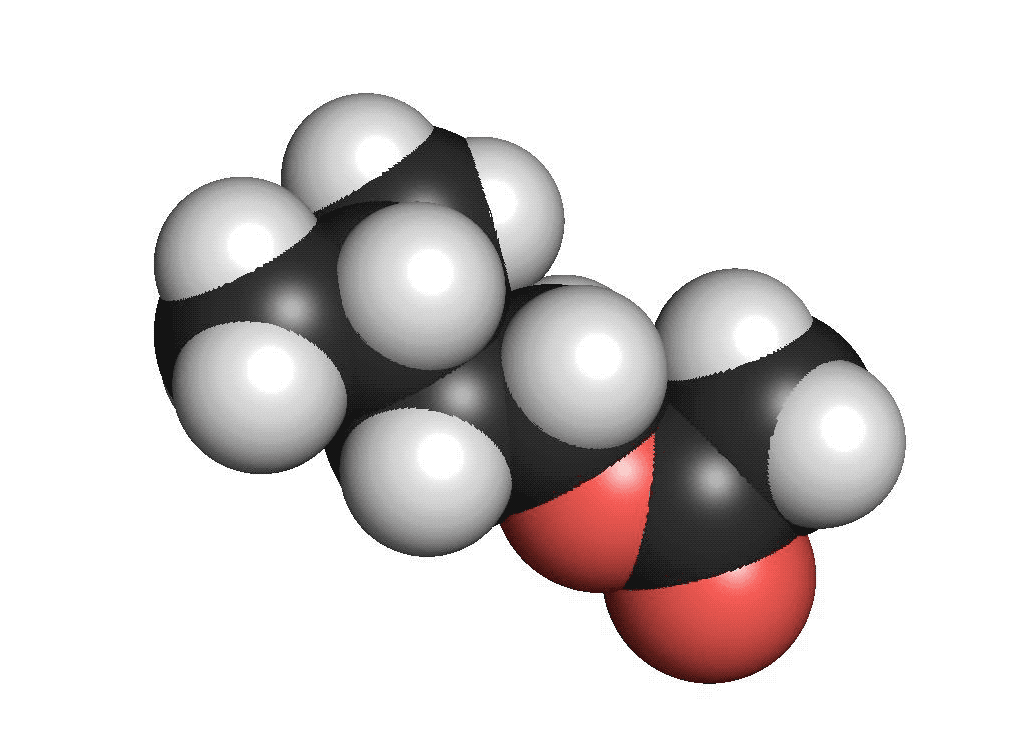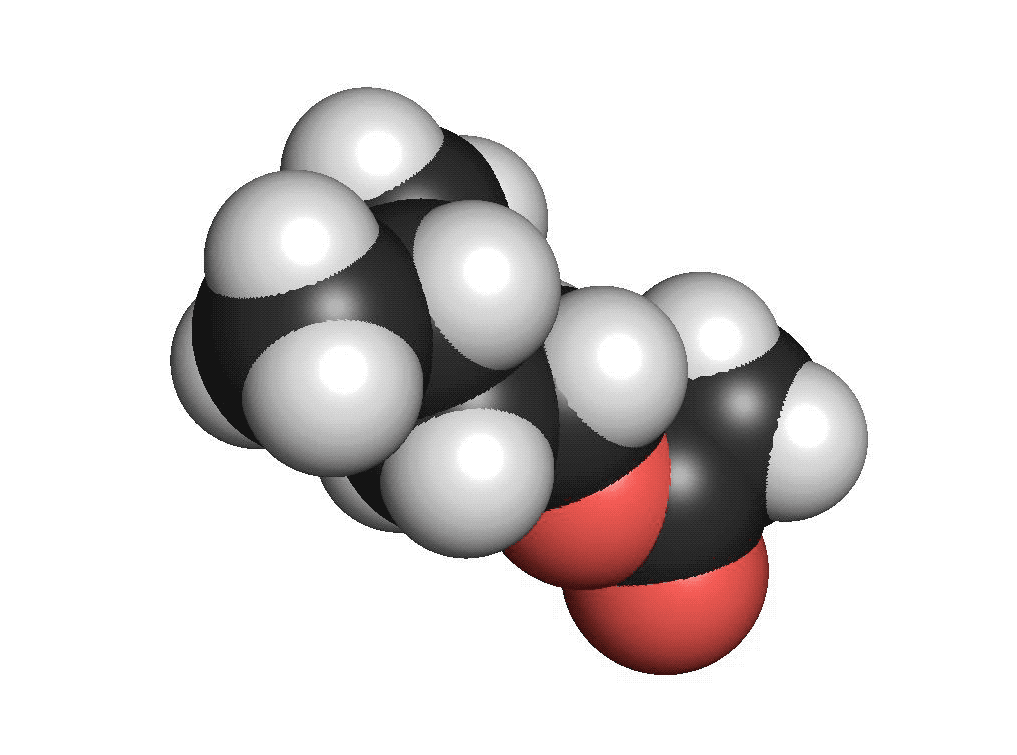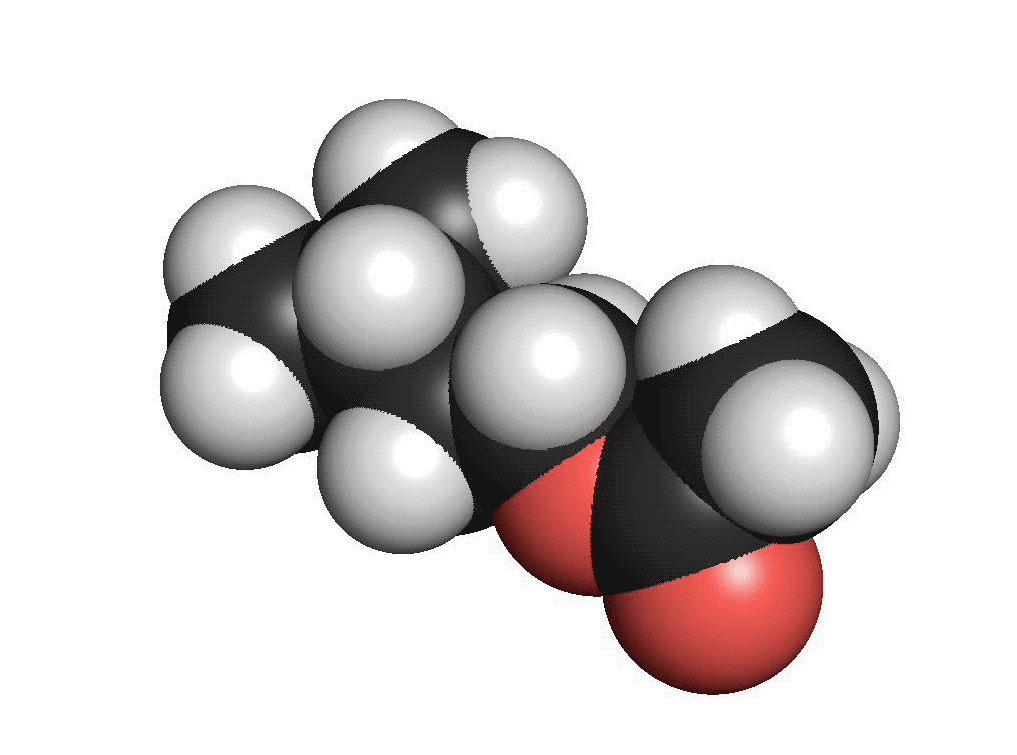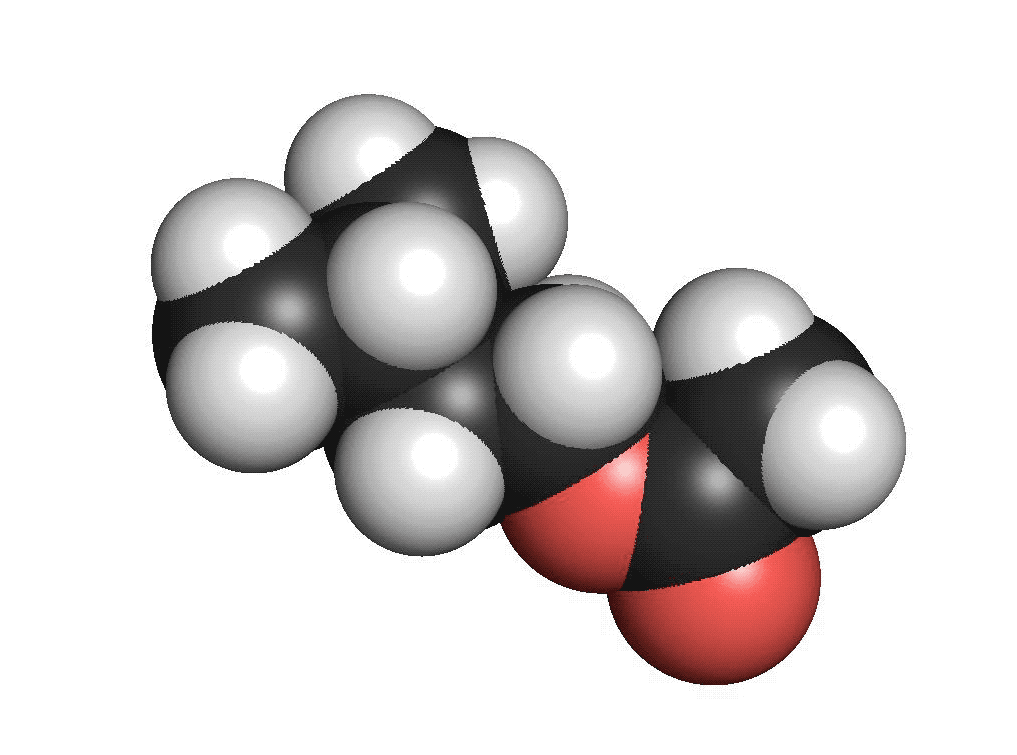
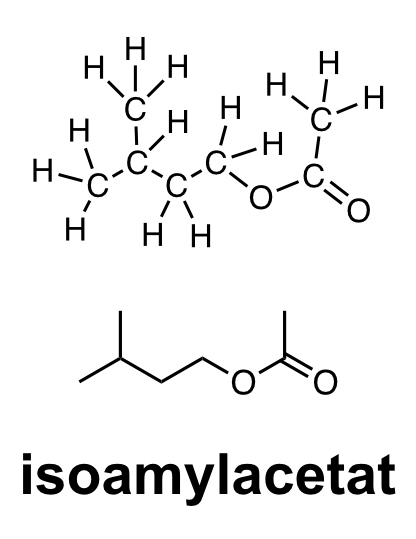
En ester liknar en karboxylsyra. Skillnaden är att väteatomen i karboxylsyragruppen är borta. Istället binder karboxylsyragruppen till fler kolatomer. En ester bildas då en alkohol får reagera med en karboxylsyra. När alkoholmolekylen och karboxylsyran binder till varandra uppstår en esterbindning. Estrar luktar ofta frukt. Många frukter innehåller estrar. Bananer innehåller bland annat en ester som heter isoamylacetat. Isoamylacetat har en tydlig bananlukt.
Aminer luktar ofta fisk
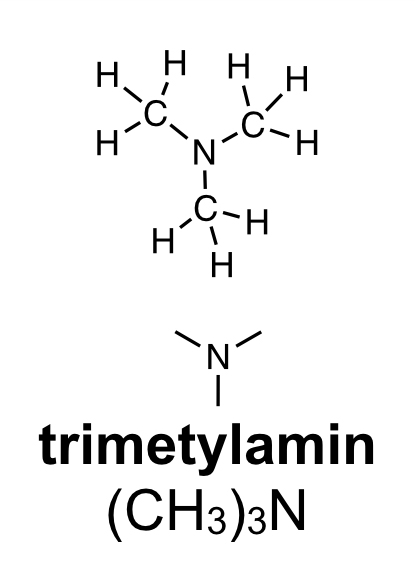
Aminer innehåller atomslaget kväve. Många aminer har en obehaglig lukt av fisk. När en död fisk ligger framme bildas ämnet trimetylamin. Trimetylamin består av en kväveatom som binder till tre kolatomer.
För att ett ämne ska lukta måste det bli gasformigtFör att vi ska kunna känna en lukt måste vi dra in molekyler i näsan. Ämnena måste därför bli gasformiga. Kemiska ämnen kan anta tre olika aggregationstillstånd. De kan vara fasta, flytande eller gasformiga. Värme är rörelse hos molekyler. Ju mer vi värmer desto mer rör de sig. När temperaturen stiger kan de röra sig så pass mycket att de lämnar vätskan och blir gas. Om man värmer tillräckligt mycket kommer alla molekyler att bli gasformiga. Det kallas för kokpunkten.
Olika ämnen kan ha väldigt varierande kokpunkter. Vatten kokar vid 100 °C. Kvävgas kokar vid –196 °C. Det krävs alltså att vi kyler ner kvävgas till nästan 200 minusgrader innan det blir en vätska. Den vätskan kallas flytande kväve. Guld är en metall. Det går att koka guld. Vi måste dock värma upp det till 2710 °C. Metaller har därför sällan någon lukt.
Ett ämne som enkelt blir gasformigt kallas för flyktigt. Hur mycket ett ämne luktar beror delvis på hur flyktigt det är. När temperaturen stiger, ökar också flyktigheten. Om vi tar ut en bit ost ur kylskåpet så luktar den inte särskilt mycket. När temperaturen ökar kommer många ämnen i osten att lättare bli gasformiga. Då luktar ostbiten mer.
För att ett ämne ska lukta måste det binda till luktreceptorerÅr 2004 fick två amerikanska forskare nobelpriset för att de utforskat luktsinnet och visat hur molekyler binder till luktreceptorer. Ämnen som liknar varandra binder ofta till samma luktreceptorer. Små variationer i kemisk struktur bestämmer sedan exakt vilken lukt det är. Många estrar luktar fruktigt. En viss ester luktar banan. En annan luktar päron. Varje typ av molekyl kan binda till flera olika luktreceptorer. Det gör att vi i teorin kan känna miljardtals olika lukter. De flesta människor brukar dock inte kunna skilja på mer än 10 000 olika lukter. Vi kommer helt enkelt inte ihåg fler lukter. Men det går att träna upp luktsinnet. Prova själv!
Quiz - Luktsinnet och molekylerUppgifter - Luktsinnet och molekyler
Förklara och beskriv
Argumentera och resonera
Ta reda på
|